Revolução no Tratamento de Câncer de Pulmão: A Esperança dos Inibidores de KRAS
Pesquisadores do Memorial Sloan Kettering Cancer Center (MSK), liderados pelo Dr. Tuomas Tammela, MD, Ph.D., fizeram um avanço significativo no tratamento do câncer de pulmão. Eles descobriram que algumas células cancerígenas de pulmão mantêm traços das células saudáveis originais, uma revelação que pode potencializar os tratamentos que utilizam a inibição do gene KRAS, uma abordagem emergente no combate a essa doença.
O foco principal do estudo foi o adenocarcinoma de pulmão, o tipo mais comum de câncer de pulmão nos Estados Unidos, responsável por 7% de todas as mortes por câncer. Essa forma de câncer geralmente é causada por mutações no gene KRAS. Embora as proteínas impulsionadas pelo KRAS tenham sido consideradas “inabordáveis” por muito tempo, recentes aprovações da FDA (Food and Drug Administration) dos EUA e vários ensaios clínicos em andamento demonstraram um novo caminho para o tratamento. No entanto, esses tratamentos não são eficazes para todos os pacientes, e muitos desenvolvem resistência, resultando no retorno do câncer.
Zhuxuan “Zoe” Li, estudante de doutorado e coautora da pesquisa, juntamente com o pós-doutorando Xueqian Zhuang, Ph.D., contribuíram significativamente para a pesquisa, revelando que o ataque a certas células cancerígenas de pulmão, que sobrevivem após o tratamento com inibidores de KRAS, poderia prevenir a recorrência do câncer. Os resultados do estudo foram publicados na revista Cancer Discovery, destacando a importância de mirar nessas células durante o tratamento com inibidores de KRAS.
Para compreender plenamente a descoberta da MSK e suas implicações, é necessário ter um conhecimento básico sobre a biologia pulmonar. Os pulmões contêm sacos de ar conhecidos como alvéolos, revestidos por dois tipos distintos de células: tipo 1 alveolar (AT1) e tipo 2 alveolar (AT2). Enquanto as células AT1 são longas e finas, facilitando a troca gasosa, as células AT2 têm um papel protetor, secretando compostos essenciais para a saúde e função pulmonares, além de ajudar na manutenção e reparo do tecido pulmonar, agindo como células-tronco.
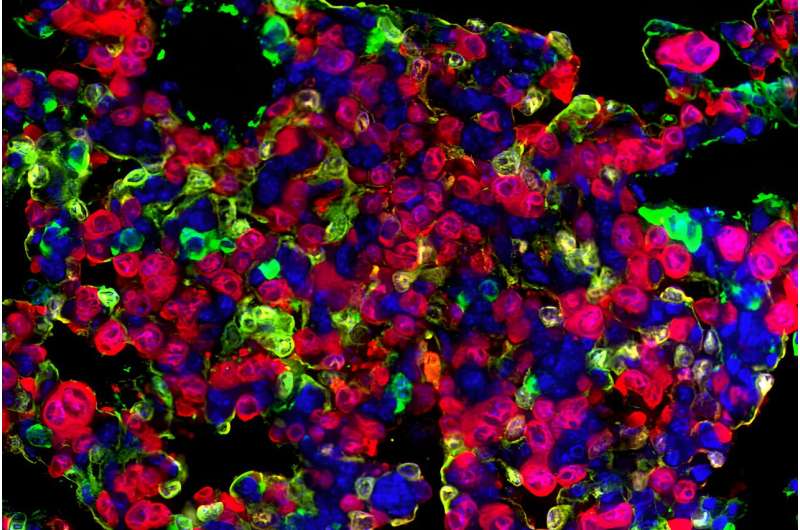
O problema surge quando as células cancerígenas de pulmão, que normalmente se desenvolvem a partir de células AT2, começam a exibir propriedades “lembradas” das células AT1, nas quais as células AT2 se diferenciam ao desempenharem seu papel de célula-tronco. Essas células cancerígenas são denominadas “células semelhantes a AT1”.
Em células saudáveis, o KRAS desempenha um papel crucial na regulação do crescimento e divisão celular. Contudo, mutações podem levar a uma proliferação celular descontrolada. Inibidores de KRAS podem interromper esse crescimento exponencial, reduzindo significativamente os tumores, mas ainda deixam para trás bolsões de células cancerígenas resistentes ao medicamento, o que dá ao câncer a chance de desenvolver novas mutações para resistir aos efeitos dos medicamentos.
O estudo utilizou modelos de camundongos geneticamente modificados, tumores derivados de pacientes e amostras de tumores para estudar essas células cancerígenas residuais. A equipe descobriu que as células que permaneciam após o tratamento eram estas células semelhantes a AT1 e que elas tinham a capacidade de reacender o crescimento descontrolado do câncer.
“Importante, descobrimos que se você eliminar essas células semelhantes a AT1, isso melhora muito a resposta ao tratamento com inibidores de KRAS”, afirmou Dr. Tammela. Eliminar essas células em modelos experimentais é relativamente fácil, mas fazer isso na clínica exigirá mais pesquisas.
“Vivemos em um tempo excitante com farmacologia fantástica”, comentou Dr. Tammela. “Podemos projetar moléculas para se ligarem a um certo tipo de célula e matá-las — é assim que funcionam a terapia com células CAR T e os conjugados de droga-anticorpo. Agora que fizemos esses experimentos de prova de conceito, o próximo passo seria encontrar proteínas de superfície que são únicas nessas células semelhantes a AT1 e, em seguida, desenvolver um tratamento que possa se ligar a elas e eliminá-las”, acrescentou ele.
A pesquisa se beneficiou de colaborações com outros laboratórios no MSK, incluindo recursos compartilhados como modelos animais e amostras de pacientes, e instalações centrais como o Núcleo de Avaliação Antitumoral e Operação Genômica Integrada. Contribuições notáveis vieram de investigadores do MSK, como Scott Lowe, Ph.D., e Charles Rudin, MD, Ph.D. Dr. Tammela destacou os papéis essenciais de Li e Zhuang no sucesso do estudo. [Medical Express]

