O modelo de átomo mais famoso não é o mais correto; veja como ele realmente é
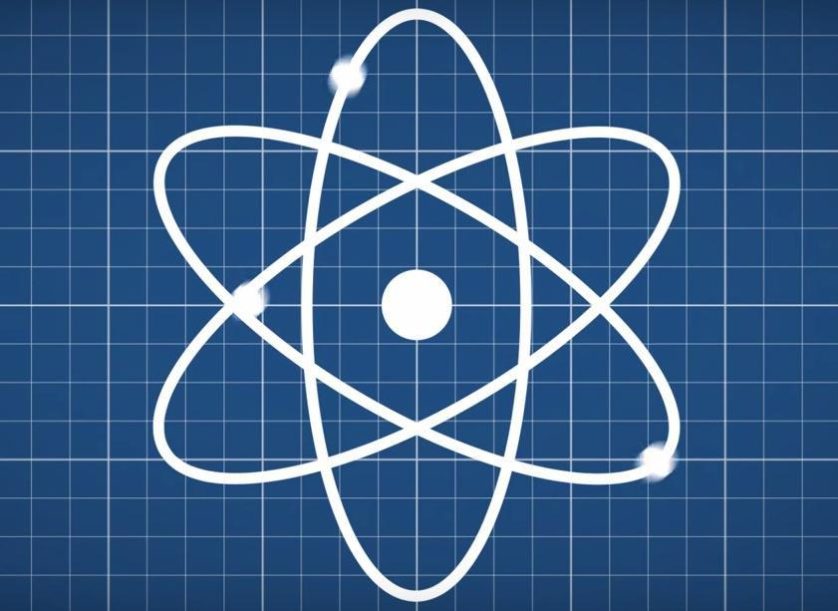
O diagrama de um átomo está entre os símbolos da ciência mais conhecidos. Infelizmente, ele não representa como os átomos realmente são, e a comunidade científica sabe disso há quase um século.
Como o diagrama surgiu
Vamos recapitular, começando no século XX. Thomson descobriu o elétron, que é a parte carregada negativamente do átomo. Ele propôs que esses elétrons eram capturados em esferas uniformes de matéria positiva. Seu modelo foi chamado de pudim de passas, já que a substância positiva com elétrons se parece com a sobremesa inglesa.
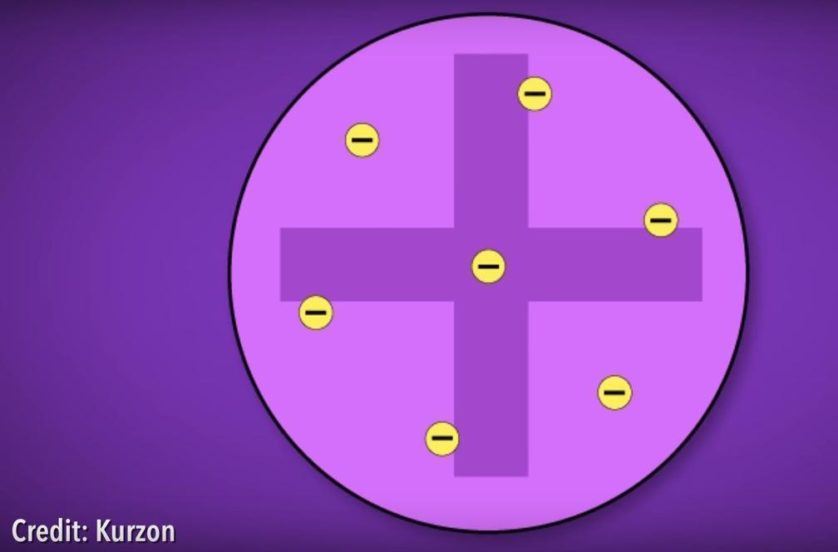
Mas o físico neozelandês Ernest Rutherford descobriu que se você disparar partículas positivas em átomos (na forma de folha de ouro), eles não são rebatidos como eles deveriam se estivessem em uma grande massa positiva. Ao invés disso, alguns desviam, enquanto a maioria passa direto, sugerindo que elétrons são distribuídos ao redor de uma pequena massa positiva: o núcleo. Ele adaptou seu modelo em 1911 para mostrar elétrons orbitando o núcleo da mesma forma que planetas orbitam o sol, o que rendeu ele o nome de “modelo planetário”.

Este se tornou o modelo mais famoso para o átomo, mesmo tendo sido redefinido apenas dois anos depois por Bohr.
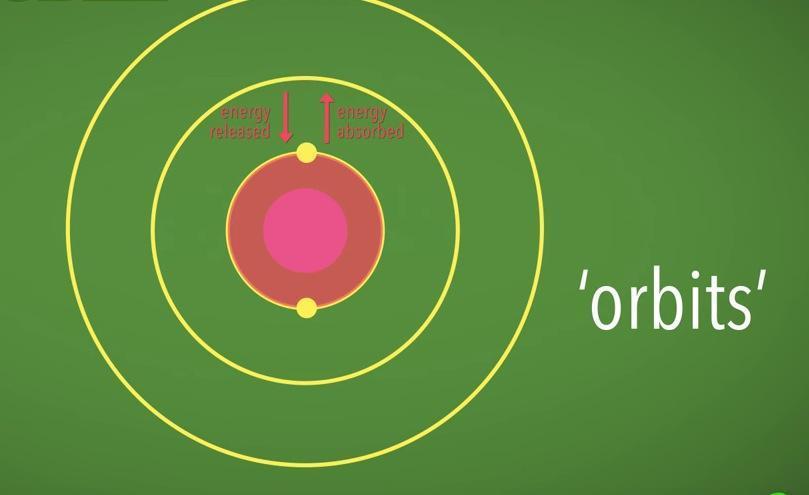
O problema com o modelo planetário é que elétrons perderiam energia ao orbitar, fazendo com que eles acabassem entrando em colisão com o núcleo. O modelo de Bohr resolveu este problema: ao invés de orbitar aleatoriamente, os elétrons orbitariam apenas em níveis bem específicos de energia. Os elétrons pulariam de nível em nível se absorvessem ou liberassem energia. Este é o modelo mais popular em livros escolares de ciências, mas há muitos problemas nele.
Qual é o melhor modelo?
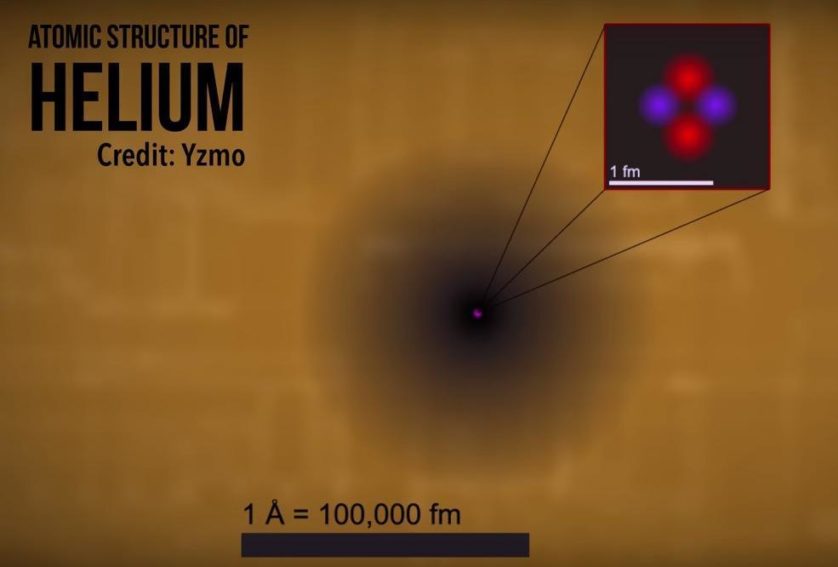
Steven Dutch da Universidade de Wisconsin Green Bay resume o próximo passo do modelo atômico: “Em 1920, físicos descobriram que a matéria também tinha propriedades de ondas, e isso não funciona no nível atômico para tratar as partículas como pequenos pontos com localizações e energia precisas. A matéria é imprecisa. Eles deixaram de pensar nos elétrons como pequenos planetas”.
Elétrons não seguem caminhos e físicos descobriram que eles são na verdade partículas quânticas que existem em vários locais diferentes de uma vez. Eles ainda ocupam níveis de energia individuais, mas ao invés de seguir um caminho, a localização de cada elétron pode ser pensada como uma nuvem. Este modelo é conhecido como o modelo da nuvem eletrônica, exibido logo acima. [Curiosity]
Veja esta explicação no vídeo, que tem opção de legenda em português:
Você sabe qual o tamanho de um átomo? Esta animação divertida explica, também com legendas em português:

5 comentários
Todos os modelos “famosos” do passado ERAM OS MAIS CERTOS na sua época.
Nunca estaremos completamente certos mas PODEMOS estar menos errados
Muito interessante. Sempre tendemos a imaginar partículas subatômicas como bolinhas.
ótimo texto e maravilhosos videos
Ops, mas o título da matéria NÃO deveria ser “COMO REALMENTE É” mas sim “como é o MODELO ATUALmente mais aceito” 😉
Perfeito, é isso mesmo!